Las proteínas son grandes moléculas orgánicas compuestas por cientos o miles de unidades químicas denominadas aminoácidos, unidos en largas cadenas enlazadas. Cada tipo de proteína posee una secuencia específica de aminoácidos.
Las proteínas son biomoléculas formadas por cadenas lineales de aminoácidos. El nombre proteína proviene de la palabra griega πρωτεῖος ("proteios"), que significa "primario" o del dios Proteo, por la cantidad de formas que pueden tomar.Por sus propiedades físico-químicas, las proteínas se pueden clasificar en proteínas simples, que por hidrólisis dan solo aminoácidos o sus derivados; proteínas conjugadas, que por hidrólisis dan aminoácidos acompañados de sustancias diversas, y proteínas derivadas, sustancias formadas por desnaturalización y desdoblamiento de las anteriores. Las proteínas son indispensables para la vida, sobre todo por su función plástica (constituyen el 80% del protoplasma deshidratado de toda célula), pero también por sus funciones biorreguladora (forma parte de las enzimas) y de defensa (los anticuerpos son proteínas
Las proteínas desempeñan un papel fundamental para la vida y son las biomoléculas más versátiles y más diversas. Son imprescindibles para el crecimiento del organismo. Realizan una enorme cantidad de funciones diferentes, entre las que destacan:
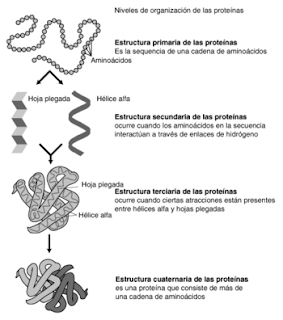
ESTRUCTURA: La organización de una proteína viene definida por cuatro niveles estructurales denominados: estructura primaria, estructura secundaria, estructura terciaria y estructura cuaternaria. Cada una de estas estructuras informa de la disposición de la anterior en el espacio.
Las proteínas son biomoléculas formadas por cadenas lineales de aminoácidos. El nombre proteína proviene de la palabra griega πρωτεῖος ("proteios"), que significa "primario" o del dios Proteo, por la cantidad de formas que pueden tomar.Por sus propiedades físico-químicas, las proteínas se pueden clasificar en proteínas simples, que por hidrólisis dan solo aminoácidos o sus derivados; proteínas conjugadas, que por hidrólisis dan aminoácidos acompañados de sustancias diversas, y proteínas derivadas, sustancias formadas por desnaturalización y desdoblamiento de las anteriores. Las proteínas son indispensables para la vida, sobre todo por su función plástica (constituyen el 80% del protoplasma deshidratado de toda célula), pero también por sus funciones biorreguladora (forma parte de las enzimas) y de defensa (los anticuerpos son proteínas
Las proteínas desempeñan un papel fundamental para la vida y son las biomoléculas más versátiles y más diversas. Son imprescindibles para el crecimiento del organismo. Realizan una enorme cantidad de funciones diferentes, entre las que destacan:
ESTRUCTURA: La organización de una proteína viene definida por cuatro niveles estructurales denominados: estructura primaria, estructura secundaria, estructura terciaria y estructura cuaternaria. Cada una de estas estructuras informa de la disposición de la anterior en el espacio.
Los nutrientes de gran importancia biológica que son las proteínas, son macromoléculas que constituyen el principal nutriente para la formación de los músculos del cuerpo.
© Estructural. Esta es la función más importante de una proteína
© Inmunológica
© Contráctil
© Homeostática: colaboran en el mantenimiento del pH
© Transducción de señales
© Protectora o defensiva
Las proteínas están formadas por aminoácidos los cuales a su vez están formados por enlaces peptídicos para formar esfingocinas.
Las proteínas de todos los seres vivos están determinadas mayoritariamente por su genética (con excepción de algunos péptidos antimicrobianos de síntesis no ribosomal), es decir, la información genética determina en gran medida qué proteínas tiene una célula, un tejido y un organismo.
Las proteínas se sintetizan dependiendo de cómo se encuentren regulados los genes que las codifican. Por lo tanto, son susceptibles a señales o factores externos. El conjunto de las proteínas expresadas en una circunstancia determinada es denominado proteoma.
ESTRUCTURA PRIMARIA
Es la secuencia de aminoácido de la proteína. Componen la cadena polipeptídica y el orden en que dichos se encuentran. La función de una proteína depende de su secuencia y de la forma que ésta adopte.
ESTRUCTURA SECUNDARIA
La estructura secundaria es la disposición de la secuencia de aminoácidos en el espacio. La medida que va siendo enlazado durante la síntesis de proteínas y gracias a la capacidad de giro de sus enlaces, adquiere una disposición espacial estable, la estructura secundaria.
Existen dos tipos de estructura secundaria:
La (alfa)-hélice
La conformación beta
Esta estructura se forma al enrollarse helicoidalmente sobre sí misma la estructura primaria. Se debe a la formación de enlaces de hidrógeno entre el -C=O de un aminoácido y el -NH- del cuarto aminoácido que le sigue.
En esta disposición forman una hélice sino una cadena en forma de zigzag, denominada disposición en lámina plegada.
Presentan esta estructura secundaria la queratina de la seda o fibroína.
Forma tridimensional que adopta la cadena polipeptídica como resultado de las propiedades químicas de los aminoácidos específicos.
La estructura terciaria informa sobre la disposición de la estructura secundaria de un polipéptido al plegarse sobre sí misma originando una conformación globular.
En definitiva, es la estructura primaria la que determina cuál será la secundaria y por tanto la terciaria.
Esta conformación globular facilita la solubilidad en agua y así realizar funciones de transporte , enzimáticas, hormonales, etc.
Esta conformación globular se mantiene estable gracias a la existencia de enlaces entre los radicales R de los aminoácidos. Aparecen varios tipos de enlaces:
El puente disulfuro entre los radicales de aminoácidos que tiene azufre.
Los puentes de hidrógeno
Los puentes eléctricos
Las interacciones hifrófobas.
Esta estructura informa de la unión, mediante enlaces débiles (no covalentes) de varias cadenas polipeptídicas con estructura terciaria, para formar un complejo proteico. Cada una de estas cadenas polipeptídicas recibe el nombre de protómero.
El número de protómero varía desde dos como en la hexoquinasa, cuatro como en la hemoglobina, o muchos como la cápsida del virus de la poliomielitis, que consta de 60 unidades proteícas.
FUNCIONES
(insolubles en el agua) localiadas en:
colageno -tejido conjuntivo
elastinas -tendones y las arterias
miosinas -tejidos musculares
queratina -pelo y las uñas
proteinas globulares
(se pueden dispersar en
soluciones acuosas) localizadas en:
albuminas - sangre
globulinas toman parte en el trasnporte del oxigeno
a todo el cuerpo(hemoglobina) y en la defensa
del organismo contra las enfermedades
(gammaglobulina)
proteinas conjugadas
(complejos de proteinas
enlazadas en otras moleculas) localizadas en los complejos de:
nucleoproteinas -proteinas y acidos nucleicos
lipoproteinas -proteinas y lipidos
fosfoproteinas -proteinas y compuestos fosforados
cromoproteinas -proteinas y pigmentos(es decir,hemoglobina)
Las proteínas ocupan un lugar de máxima importancia entre las moléculas constituyentes de los seres vivos. Prácticamente todos los procesos biológicos dependen de la presencia o la actividad de este tipo de moléculas. Bastan algunos ejemplos para dar idea de la variedad y trascendencia de las funciones que desempeñan. Son proteínas:
Funciones de las proteínas son transportar las sustancias grasas a través de la sangre, elevando así las defensas de nuestro organismo. Por lo tanto la ingesta diaria de estos nutrientes que son las proteínas es imprescindible para una dieta sana y saludable para todos siendo la ingesta de alimentos ricos en proteínas de especial importancia en la nutrición deportiva.
Todas las proteínas realizan elementales funciones para la vida celular, pero además cada una de éstas cuenta con una función más específica de cara a nuestro organismo.
Debido a sus funciones, se pueden clasificar en:
q Catálisis: Está formado por enzimas proteicas que se encargan de realizar reacciones químicas de una manera más rápida y eficiente. Procesos que resultan de suma importancia para el organismo. Por ejemplo la pepsina, esta enzima se encuentra en el sistema digestivo y se encargan de degradar los alimentos.
q Reguladoras: Las hormonas son un tipo de proteínas las cuales ayudan a que exista un equilibrio entre las funciones que realiza el cuerpo. Tal es el caso de la insulina que se encarga de regular la glucosa que se encuentra en la sangre.
q Estructural: Este tipo de proteínas tienen la función de dar resistencia y elasticidad que permite formar tejidos así como la de dar soporte a otras estructuras. Este es el caso de la tubulina que se encuentra en el cito esqueleto.
q Defensiva: Son las encargadas de defender al organismo. Glicoproteínas que se encargan de producir inmunoglobulinas que defienden al organismo contra cuerpos extraños, o la queratina que protege la piel, así como el fibrinógeno y protrombina que forman coágulos.
q Transporte: La función de estas proteínas es llevar sustancias a través de todo el organismo donde son requeridas. Proteínas como la hemoglobina que lleva el oxígeno por medio de la sangre.
q Receptoras: Este tipo de proteínas se encuentran en la membrana celular y llevan a cabo la función de recibir señales y para que la célula así pueda realizar su función. El acetilcolina que recibe señales para producir la contracción muscular
METABOLISMO DE LAS PROTEÍNAS
Son macromoléculas constituidas por la polimerización de las unidades estructurales básicas denominadas aminoácidos (a veces compuestos derivados de los mismos) que se unen entre sí mediante enlaces peptídicos (tipo Amida).
Dos aminoácidos unidos entre sí por un enlace peptídicos forman un dipéptido, sin son 3 serían un tripéptido y así sucesivamente. Los compuestos así formados por menos de 100 aminoácido se denominan péptidos (o polipéptidos) cuando el número de aminoácidos es mayor de 100 el compuesto se denomina proteína.
Aminoácidos: son compuestos químicos caracterizados por poseer un grupo funcional amino (-NH2) y otro ácido (-COOH) unidos a una cadena lateral (-R). [Si el grupo –R es un hidrógeno se habla de glicocola –R = H)
De todos los aminoácidos conocidos (más de un centenar) simplemente 20 son componentes naturales de las proteínas, el resto son productos intermedios o finales del metabolismo. Los aminoácidos básicamente se diferencian entre sí, por la naturaleza de la cadena lateral y es debido a ella que cada aminoácido tenga propiedades únicas y características. Las diferentes cadenas –R se diferencian entre sí en función de:
Ø Su forma y tamaño
Ø La carga
Ø Por la reactividad
Ø Por la capacidad de formar enlaces puentes de hidrógeno (puentes de H)
La eliminación renal de los aminoácidos es inapreciable porque aunque se filtre a través del glomérulo (por su pequeño tamaño) son reabsorbidos en el túbulo proximal.
Su catabolismo (destrucción) sucede mediante transaminación o desaminación oxidativa y tiene lugar en el hígado y en el músculo. El destino de la cadena hidrocarbonas (-R), es la síntesis de glucosa mediante gluconeogénesis o el ingreso en el ciclo de Krebs para la obtención de energía.
El grupo amino cuando no es utilizado para la transaminación es degradado hasta amoniaco (NH3) que en el hígado se transforma en urea y glutamina
CLASIFICACIÓN DE LAS PROTEINAS
Aunque en ocasiones se emplea una clasificación basada en las funciones de las proteínas, con frecuencia se recurre a otros criterios, como su composición y complejidad, que permiten dividirlas en dos grandes grupos:
Holoproteínas.
Según su estructura tridimensional, las Holoproteínas se subdividen en proteínas globulares (redondeadas, con un alto grado de plegamiento y normalmente solubles) y fibrilares (lineales, con una estructura terciaria menos compleja e insolubles).
Algunas proteínas con estructura globular pueden adquirir estructura fibrilar y hacerse insolubles. Éste es el caso de la transformación de fibrinógeno en fibrina durante el proceso de la coagulación sanguínea. Los filamentos de fibrina crean una red donde los glóbulos rojos quedan atrapados y forman el coágulo.
- Albúminas. Constituyen un grupo de proteínas grandes, que desempeñan funciones de transporte de otras moléculas o de reserva de aminoácidos. Se pueden diferenciar a su vez en lactoalbúminas, ovoalbúminas y sero-albúminas, según se localicen en la leche, en la clara de huevo o en el plasma sanguíneo, respectivamente. Son las proteínas más grandes, pudiendo llegar a alcanzar masas moleculares de 1000 000. Como su nombre indica, su forma globular es muy perfecta. Se incluyen en este grupo algunas Heteroproteínas, como la hemoglobina.
- Histonas. Poseen una masa molecular baja y contienen una gran proporción de aminoácidos básicos. Asociadas al ADN, forman parte de la cromatina y desempeñan un papel muy importante en los procesos de regulación génica
o Queratina. Presente en las células de la epidermis de la piel y en estructuras cutáneas como pelos, plumas, uñas y escamas, es una proteína rica en el aminoácido cisteína.
o Colágeno. Su resistencia al estiramiento justifica su presencia en los tejidos conjuntivo, cartilaginoso y óseo. Posee una estructura secundaria característica compuesta por tres cadenas trenzadas.
o Miosina. Esta proteína participa activamente en la contracción de los músculos.
o Elastina. Como su nombre indica, posee una gran elasticidad que le permite recuperar su forma tras la aplicación de una fuerza. Debido a esta propiedad, la elastina se encuentra en órganos sometidos a deformaciones reversibles, como los pulmones, las arterias o la dermis de la piel
o Heteroproteínas, proteínas complejas o conjugadas. Además de las cadenas polipeptídicas, están compuestas también por una parte no proteica que se denomina grupo prostético.
Heteroproteínas.
Según la naturaleza del grupo prostético, las Heteroproteínas se clasifican en fosfoproteínas, glucoproteínas, lipoproteínas, cromoproteínas y nucleoproteínas.
ʚ Fosfoproteínas. Su grupo prostético es el ácido ortofosfórico. Ejemplos de fosfoproteínas son la vitelina, presente en la yema de huevo, y la caseína, abundante en la leche y proteína principal del queso.
ʚ Glucoproteínas. Su grupo prostético está formado por un glúcido. Se encuentran en las membranas celulares, donde desempeñan una función antigénica. Las gammaglobulinas con función de anticuerpos son, así mismo, glucoproteínas. También se incluyen en este grupo el mucus protector de los aparatos respiratorio y digestivo, algunas hormonas y el líquido sinovial presente en las articulaciones.
ʚ Lipoproteínas. Su grupo prostético es un lípido. Aparecen en las paredes bacterianas y en el plasma sanguíneo, donde sirven como transportadores de grasas y colesterol.
ʚ Cromoproteínas. Tienen como grupo prostético una molécula compleja que posee dobles enlaces conjugados, lo que les confiere color. Hemoglobina, porfirina, hemocianina, citocromos… pertenecen a este grupo.
ʚ Nucleoproteínas. Su grupo prostético está formado por ácidos nucleídos. Las nucleoproteínas constituyen la cromatina y los cromosomas
BIBLIOGRAFIA
victor m. ramirez regalado,quimica I y II,grupo partia,2007,pag522-523